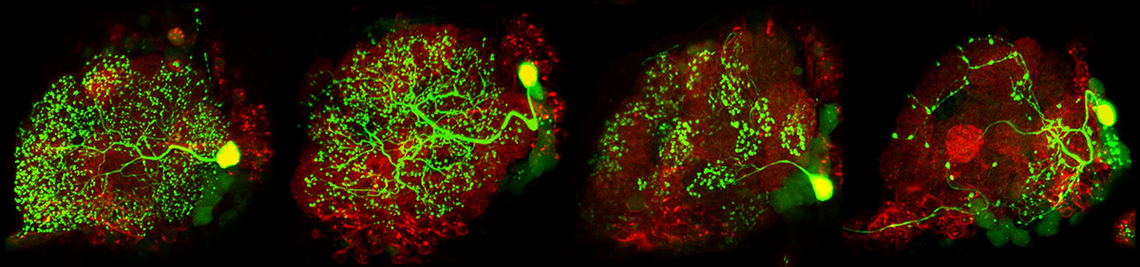
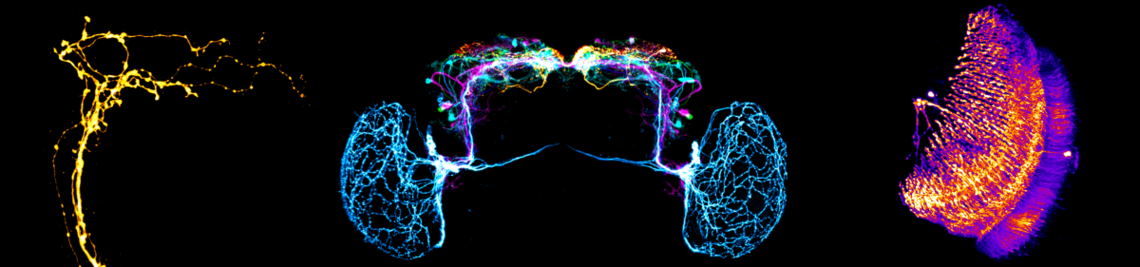
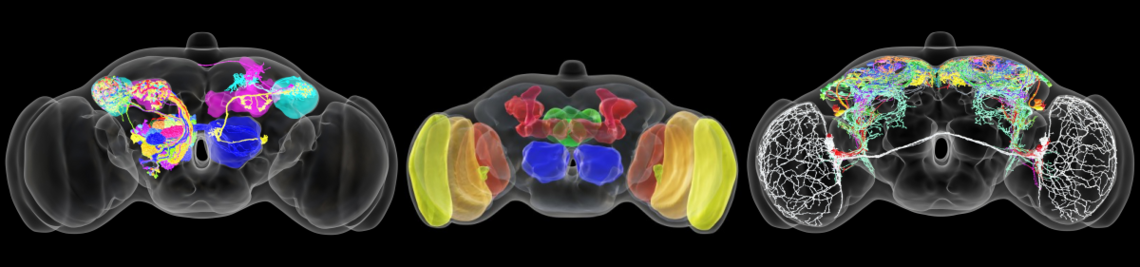
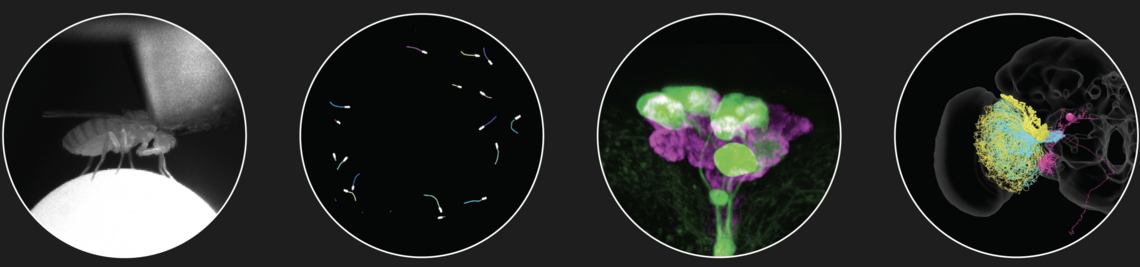
Abgeschlossene Projekte
Abgeschlossene Verbundprojekte
- GRK 640: Sensory photoreceptors in natural and artificial systems
- SFB 554: Mechanismen und Evolution des Arthropodenverhaltens: Gehirn - Individuum - Soziale Gruppe
- SFB 581: Molekulare Modelle für Erkrankungen des Nervensystems"-Molecular models of diseases in the nervous system
- Euclock: Entrainment of the Circadian Clock
- SFB 581: TP B 28 Störung im Schlaf-Wachverhalten verursacht durch Transmissions-defekte an dopaminergen und serotonergen Tripartite Synapsen am Modell Drosophila
- SFB 1047 Insect timing: mechanisms, plasticity and interactions
- FP7-People-2012-ITN: INsecTIME
Abgeschlossene Sachbeihilfen
Chronobiology is the study of biological rhythms. The best understood cycles are those with circadian 24 hour periods that modulate the temporal dynamics of physiology and behaviour of all higher organisms and some bacteria. Four model organisms have been widely used to study the underlying biology of circadian clocks, Cyanobacteria, the fungus Neurospora, the fruitfly Drosophila, and the mouse. CINCHRON is an integrated European centre of excellence for the research training of researchers in the emerging multidisciplinary field of Comparative INsect CHRONobiology. The 2017 Nobel Prize for Medicine or Physiology was awarded jointly to three of our colleagues, Jeffrey Hall and Michael Rosbash (both at Brandeis University, Boston, USA) and Michael Young (Rockefeller University, New York, USA) for their work on the molecular dissection of the circadian clock in Drosophila. Our warmest congratulations to these outstanding fly molecular geneticists for their achievements, which is particularly heartfelt because seven of the principle investigators of CINCHRON have worked and published with Hall and Rosbash. Insect clocks, both circadian and seasonal, are vital for adaptation to the environment and recent global patterns of climate change mean that insect pests and vectors of disease are expanding their ranges into Europe. Consequently there is an urgent need to study the circadian clocks of these insects and how they synchronise to the environment. CINCHRON will contribute to the integration and cohesion of future European research efforts in solving pure and applied biological problems.
Host Institution: Wuerzburg University
Supervisor: Prof Charlotte Helfrich-Foerster
Project 1: Seasonal clock in D. littoralis
Objectives: To discover the role played by the circadian clock in night-length measurement and induction of diapause in the northern European fruifly D. littoralis. The role and distribution of clock proteins and relevant clock-related neuropeptides will be studied under different photoperiodic and temperature conditions and mutagenesis (CRISPR/Cas9) of canonical clock genes will be used to examine whether clock genes measure night-length (which mediates diapause).
Project 2: Seasonal clock in pea aphids
Objectives: To discover the role played by the circadian clock in the induction of diapause in the pea aphid Acyrthosiphon pisum. Circadian behaviour will be characterised as will neuronal clock gene expression both temporally and spatially. CRISPR/Cas9 mutagenesis will be used to investigate whether clock mutations disrupt diapause.
Die Taufliege Drosophila melanogaster - wird erfolgreich als Modellsystem zur Erforschung der Funktionsweise innerer Uhren benutzt. Wie bei Säugern werden bei der Taufliege molekulare Oszillationen in einzelnen Schrittmacherneuronen erzeugt, die in einem komplizierten Netzwerk miteinander kommunizieren. Wesentliche Neurotransmitter in diesem Netzwerk sind Neuropeptide. Bei Drosophila wurde bisher vor allem die Bedeutung des "pigment-dispersing-factor" (PDF) in der Inneren Uhr untersucht. PDF wird pro Gehirnhemisphäre in 4 großen und 4 kleinen Neuronen exprimiert und scheint als Kopplungssignal zwischen einzelnen Schrittmacherneuronen zu wirken sowie in den kleinen Neuronen zusätzlich als circadianes Ausgangssignal und in den großen Neuronen als Lichteingangssignal. Neben den 8 PDF Neuronen gibt es 7 weitere Neuronen im lateralen Gehirn, die wesentlich an der Kontrolle der Aktivitätsrhythmik mitwirken. Vier dieser Neuronen exprimieren das Neuropeptid F und zwei davon zusätzlich das Ionen-Transport-Peptid ITP. Die Rolle dieser 4 Neurone und der großen PDF-Neurone sowie der drei Peptide in der Inneren Uhr von Drosophila soll in diesem Projekt genauer untersucht werden. Dazu gehört insbesondere ihre Wirkung auf die dorsalen Neurone sowie auf der Uhr nachgeschaltete Neurone.
Eine grundlegende Eigenschaft von circadianen Rhythmen ist ihre Fähigkeit, sich an die natürlichen tagesperiodischen Veränderungen anpassen zu können. Dabei wirken Licht-Dunkel-Zyklen als wichtigster und Temperaturzyklen als zweitwichtigster Zeitgeber für die Synchronisation der endogenen Rhythmen an die Umwelt. Das circadiane Schrittmacher-System von Drosophila melanogaster besteht aus mehreren gut charakterisierten Neuronengruppen, die auf komplexe Weise miteinander interagieren und die für die Fliege typischen Aktivitätsgipfel am Morgen und Abend kontrollieren. Licht verkürzt die Periode einer Gruppe der Lateralen Neuronen (LN), während es die von anderen Gruppen verlängert. Dadurch wird gewährleistet, dass Morgen- und Abendaktivitätsgipfel an Licht-an bzw. Licht-aus gekoppelt sind. Diese Reaktion wird in erster Linie durch Rhodopsine in den Komplexaugen vermittelt. Zusätzlich sind letztere auch für direkte Lichteffekte auf die Aktivität verantwortlich (sogenannte Maskierungseffekte). In der kommenden Antragsperiode soll aufgeklärt werden welche der 6 möglichen Rhodopsine (Rh1, Rh3, Rh4, Rh5, Rh6 und Rh7) die unterschiedlichen Reaktionen verursachen und auf welche Neuronengruppen Licht, das über die Komplexaugen wahrgenommen wird, in erster Linie synchronisierend wirkt. Temperatur-Zyklen scheinen auf andere Neuronengruppen synchronisierend zu wirken als Licht. So werden durch Temperaturzyklen vorwiegend eine erst kürzlich entdeckte Gruppe von Lateralen Neuronen im posterioren Gehirn (LPN) sowie einige Dorsale Neuronen (DN) synchronisiert. Interessanterweise fehlt diesen Neuronen das Blaulichtphotopigment Cryptochrom. Der Beitrag dieser Zellen zur Synchronisation soll in Temperatur- und LD-Zyklen mit unterschiedlichen Zeitgeberperioden getestet werden. Wir versprechen uns von den Versuchen ein besseres Verständnis der Synchronisationsmechanismen innerer Uhren auf zellulärer Ebene.
Chronischer psychosozialer Stress und die Fehlregulation der Inneren Uhr haben vieles gemeinsam. Beide wirken sich negativ auf Gesundheit und Lebensdauer aus, und beeinflussen die Aktivität der HPA-Achse und somit zirkulierende Glucocorticoide (GC) sowie das Immunsystem unter Verwendung ähnlicher Neuropeptide als Signalmoleküle. Anatomisch haben die Innere Uhr und das Stress System ein gemeinsames Interface, den hypothalamischen Nucleus paraventricularis (PVN), dessen CRF-positive Neuronen bei Stimulation durch Stress oder die Innere Uhr Corticotropin Releasing Factor (CRF) abgeben, und der maßgeblich die adrenale GC Synthese und Sekretion reguliert. Der PVN ist unter regulatorischer Kontrolle des SCN, der die circadiane Rhythmik der HPA-Achse und somit den täglichen, Stress-unabhängigen Anstieg des GC Spiegels zur Vorbereitung auf die aktive Tagesphase bestimmt. Dieses Projekt untersucht eine mögliche Interaktion zwischen psychosozialem Stress und der Inneren Uhr im SCN. Wir werden untersuchen, (i) ob die Innere Uhr die Stressempfindlichkeit tageszeitabhängig moduliert und (ii) ob wiederholter psychosozialer Stress die Innere Uhr in Abhängigkeit von der Tageszeit der Stress-Exposition beeinflusst. Mäuse werden entweder morgens oder abends „social defeat“ (SD) Stress ausgesetzt und die physiologischen Konsequenzen von Stress untersucht sowie das rhythmische Verhalten und die molekularen Oszillationen im Gehirn.
Die Transmitterhomöostase ist wichtig für eine normale Funktion des Gehirns, und Gliazellen spielen eine wichtige Rolle bei ihrer Aufrechterhaltung. Störungen dieser Homöostase bewirken u.a. ein abnormales Schlafwachverhalten. In diesem Projekt soll die mögliche Regulation der Monoaminausschüttung (insbesondere von Dopamin und Serotonin) durch postulierte Tripartit Synapsen zwischen monoaminergen Neuronen, Gliazellen und Neuronen der inneren Uhr untersucht werden. Hierbei dient die Taufliege Drosophila melanogaster als Modellsystem.
Bei der Fliege bewirkt eine Mutation in der Monamin-Alanyl-Transferase Ebony, die ausschließlich in Gliazellen exprimiert wird, ein gestörtes Schlafwachmuster. Detaillierte morphologische Untersuchungen (konfokal und EM) sollen zeigen, ob es die postulierten Tripartit Synapsen gibt. Schlafwachstudien an verschiedenen Mutanten-Kombinationen mit beeinträchtigtem Monoamintransport und beeinträchtigter Monamin-Alanyl-Transferase Funktion sollen die für einen normalen Schlaf entscheidenden synaptischen Regulationsprozesse klären. Ca++-Imaging sowie Period-Luciferase Reporter Imaging an kultivierten Gehirnen werden eingesetzt, um die Reaktion der Uhrneuronen und Gliazellen auf Monoamine zu untersuchen sowie die Reaktion auf verschiedene Pharmaka, die in den Stoffwechsel dieser Transmitter eingreifen.
Tiere, die in nördlichen Breitengraden leben, sind ausgeprägten jahreszeitlichen Änderungen ihrer Umwelt ausgesetzt. Im Sommer erfahren sie lange Tage und kurze Nächte mit moderaten Temperaturen, die die Fortpflanzung erlauben, während die kurzen Tage und niedrigen Temperaturen des Winters spezielle Anpassungen zum Überleben erfordern wie zum Beispiel Frostresistenz und eine Unterbrechung der Fortpflanzung.
Im Gegensatz dazu erfahren Tiere, die nahe am Äquator leben, kaum jahreszeitliche Änderungen und Einschränkungen in der Fortpflanzung. Die circadiane Uhr im Gehirn ist dafür bekannt, Tag-Nacht Rhythmen in der Aktivität zu kontrollieren und zusätzlich eine interne Zeitreferenz für die Tageslängenmessung zu liefern.
Wir haben herausgefunden, dass sich die Tag-Nacht Rhythmen und die Neurochemie des Uhrnetzwerkes im Gehirn von Drosophila Arten, die an verschiedenen Breitengraden leben, signifikant voneinander unterscheiden und dass es eine kausale Beziehung zwischen beidem gibt.
Um die Evolution circadianer Uhren zu verstehen, planen wir das Uhrnetzwerk im Gehirn und das tägliche Aktivitätsmuster von weiteren Drosophila Arten zu untersuchen, die von verschiedenen Breitengraden stammen. Wir versprechen uns von den Untersuchungen verschiedener in unterschiedlichen Breitengraden lebenden Drosophila Arten zum Verständnis der Evolution innerer Uhren beizutragen.
Die Familie der Drosophiliden umfasst tropische, kosmopolitische und subarktische Arten. Das Ziel unserer Studie ist die Aufklärung der neuronalen Uhr-Mechanismen, die die Aktivitätsrhythmik von Fliegen an höhere Breitengrade anpasst (Projekt 1), sowie der molekularen Mechanismen, die die Tageslängenmessung und Anpassung an den Winter ermöglichen (Projekt 2). In Projekt 1 konnten wir zeigen, dass das molekulare Uhr-Netzwerk der eigentlich tropischen Drosophila melanogaster als ursprünglich anzusehen ist und dass verschiedene Drosophila-Arten unterschiedliche Wege eingeschlagen haben, um ihre Uhren an höhere Breitengrade anzupassen. Alle Wege haben gemeinsam, dass sie die circadiane Uhr plastischer machen, so dass die tägliche Aktivität den sich ändernden Photoperioden folgen kann. Dies kann durch den Verlust von PDF (Pigment-Dispersing Factor) und CRY (Cryptochrom) in bestimmten Uhr-Neuronen erfolgen (z.B. bei der virilis Gruppe), durch Eliminierung der rhythmischen PDF-Sekretion (z.B. bei Chymomyza) oder durch Reduktion der Lichtempfindlichkeit von CRY oder seiner Interaktion mit TIM (Timeless) (vermutlich bei D. funebris). In der zweiten Förderperiode möchten wir die bereits begonnene Analyse von ~30 Drosophila-Arten aus verschiedenen Breitengraden fertig stellen, um tiefere Einsichten in die Evolution von circadianen Uhren zu gewinnen. Außerdem wollen wir uns auf die Erforschung der circadianen Uhr von D. funebris konzentrieren, da diese Fliegenart außergewöhnlich gut an das Leben in subarktischen und gemäßigten Breiten angepasst ist und neue Einsichten in die Anpassung von circadianen Uhren an die Umwelt verspricht. In Projekt 2 haben wir gefunden, dass die Distanz zwischen den Maxima von PER (Period) und TIM in den Uhr-Neuronen von D. melanogaster für die Tageslänge zu kodieren und die Frostresistenz zu bestimmen scheint: Unter Kurztagbedingungen sind die Maxima der oszillierenden Uhrproteine nahe zusammen und die Fliegen sind frostresistenter als unter Langtagen, wenn ihre Maxima weit auseinander liegen. Weiterhin haben wir 79 Gene identifiziert, deren Expression sich in spezifischen Uhrneuronen unter Kurz- und Langtagen verändert und deren genaue Rolle bei der saisonalen Anpassung wir nun untersuchen wollen. Dabei werden wir die vielversprechendsten Kandidaten im Vergleich mit anderen Drosophila-Arten ermitteln, diese dann bei D. melanogaster genetisch manipulieren und die Frostresistenz der Tiere bestimmen. Mit neurogenetischen Methoden werden wir bei D. melanogaster auch die Uhr-Neuronen ermitteln, die für die Saisonalität verantwortlich sind. Dies wird uns u.a. die bei nördlichen Arten gefundenen Modifikationen im Uhrnetzwerk verstehen helfen. Außerdem werden wir mit Hilfe der CRISPR-Cas9 Technik per und tim Null Mutanten in D. suzukii generieren, um die Rolle der circadianen Uhr für die Saisonalität in einer Art mit starken saisonal-bedingten morphologischen Veränderungen relativ einfach untersuchen zu können.
Die circadiane Uhr ermöglicht es Tieren, sich im Voraus auf den Tag-Nacht-Wechsel vorzubereiten. Manchen Arten nutzen ihre Uhr auch zum Zeitgedächtnis, zum Messen der Tageslänge um jahreszeitliche Änderungen vorherzusehen, sowie für die zeitkompensierte Himmelskompassorientierung. Das Uhrnetzwerk im Gehirn der Taufliege gehört zu den bestuntersuchten. Es besteht aus miteinander kommunizierenden lateralen und dorsalen Uhrneuronen, die einen circadianen molekularen Rhythmus erzeugen und diesen an nachgeschaltete Neuronen im dorsalen Protocerebrum weitergeben. Die Taufliege ist ein Modell in der Schlafforschung, es gelang, Verbindungen der circadianen Uhr zum Metabolismus aufzuschlüsseln, zu zeigen, dass Taufliegen ein Zeitgedächtnis besitzen und dass die circadiane Uhr bei der Induktion der Winterruhe eine Rolle spielt. Erste Untersuchungen deuten darauf hin, dass die Fliege sogar zur zeitkompensierten Himmelkompassorientierung befähigt ist. Bei all diesen Funktionen scheinen die dorsalen Uhrneurone eine wichtige Rolle zu spielen. Während die lateralen Uhrneurone als übergeordnete „circadiane Masteroszillatoren“ gelten, sind die dorsalen Neurone multimodale Integratoren, die den Rhythmus an Interneurone und neurosekretorische Zellen weitergeben. In der Literatur finden sich allerdings widersprüchliche Angaben zur genauen Funktion der dorsalen Uhrneurone. So machen manche Autoren eine Gruppe der dorsalen Uhrneurone (DN1p) für die Induktion des Schlafes verantwortlich, während andere Autoren eine Rolle der gleichen Neuronen bei der Erhöhung des Stoffwechsels und der neuronalen Erregung postulieren. Ein Grund für die widersprüchlichen Ansichten könnte im unterschiedlichen Projektionsmuster individueller dorsaler Uhrneurone liegen.
Praktisch alle Lebewesen auf unserem Planeten zeigen tägliche und saisonale Rhythmen. Diese Rhythmen werden durch endogene Uhren erzeugt, die es Organismen, einschließlich Menschen, ermöglichen, tägliche und saisonale Lebenszyklusfunktionen mit rhythmischen Änderungen ihrer Umgebung zu synchronisieren. Unser derzeitiges molekulares Verständnis von biologischen Rhythmen und Uhren ist jedoch hauptsächlich auf terrestrische Modellarten beschränkt. Im Gegensatz dazu wissen wir sehr wenig über die endogenen Uhren mariner Organismen und wie sie mit Umweltzyklen interagieren. Dies gilt insbesondere für marine ökologische Schlüsselarten wie den im Südpolarmeer endemischen Antarktischen Krill (Euphausia superba). Sein Lebensraum in den hohen Breitengraden ist durch extreme jahreszeitliche Umweltveränderungen gekennzeichnet (Tageslänge, Lichtintensität, Nahrungsverfügbarkeit) und zählt zu den sich am schnellsten erwärmenden Gebieten auf der Erde. Diese fein abgestimmten Wechselwirkungen, zwischen Organismen wie Krill und ihrem Lebensraum, die sich über Jahrmillionen entwickelt haben, werden durch die Folgen des schnell voranschreitenden Klimawandels beeinflusst. Daher ist es unser übergeordnetes Ziel, herauszufinden, wie rhythmische Umweltsignale (Tag / Nacht-Zyklus, Photoperiode) molekulare Oszillationen erzeugen und insbesondere polaren Meeresorganismen wie dem Antarktischen Krill ermöglichen, rhythmische Veränderungen in ihrer Umgebung zu antizipieren und ihren Lebenszyklus dementsprechend zu synchronisieren. Um dies zu erreichen, wollen wir die Beteiligung der endogenen Uhr an zentralen Lebenszyklusfunktionen im Antarktischen Krill mithilfe von saisonalen Verhaltensexperimenten, sowie Genexpressionsanalysen von Markergenen der inneren Uhr und Stoffwechselprozessen, untersuchen. Darüber hinaus wollen wir den Ort und die Anatomie der zirkadianen Uhr im Gehirn von E. superba durch In-situ-Hybridisierung und immunozytochemische Studien charakterisieren, um die molekularen und neuronalen Mechanismen zu verstehen, die der endogenen Uhr zugrunde liegen. Schließlich werden wir die endogene Uhr experimentell manipulieren, um zu verstehen, wie der endogene Rhythmus und die äußeren Bedingungen das Verhalten und die Physiologie des Antarktischen Krills bestimmen. Wir hoffen mit den geplanten Arbeiten die Mechanismen zu verstehen, die der Anpassung an extreme Umweltbedingungen in Polarregionen zugrunde liegen, und Krill‘s Plastizität im Hinblick auf anhaltende Ökosystemveränderungen im Südpolarmeer bedingen.
Mehr...
Die Mitogen-aktivierte Protein Kinase ERK als Bestandteil des gleichnamigen Signalwegs reguliert eine Vielzahl intrazellulärer Prozesse. Obwohl hauptsächlich im Kontext von Proliferation, Differenzierung und Apoptose betrachtet, werden über ERK unter anderem auch neuronale und circadiane Prozesse reguliert. In Folge dessen führt die Fehlregulation des ERK Signalsignalwegs nicht nur zu Tumorgenese, sondern ist auch mit neuronalen Fehlfunktionen und neuropsychiatrischen Erkrankungen verbunden.RSK Proteine erfüllen bei der Weiterleitung von ERK Signalen vielfältige Funktionen, die jedoch insbesondere im Nervensystem nur sehr unvollständig verstanden sind. Dies drückt sich in dem leider unzureichenden Kenntnisstand zur Pathophysiologie aus, die durch Mutation des menschlichen rsk2 Gens verursacht wird und zu schwersten geistigen Beeinträchtigungen führt (Coffin-Lowry-Syndrom). Dieser Antrag zielt darauf ab, im Modellsystem Drosophila melanogaster neuronale Funktionen von RSK aufzuklären. Dabei nutzen wir das Netzwerk der Uhrneuronen als besonders geeignetes experimentelles Modell für einen integrativen Ansatz, der die Brücke zwischen der molekularen Analyse, den zellulären/physiologischen Prozessen und der Verhaltensebene schlägt. Auf der Grundlage unserer früheren Befunde wollen wir zunächst einen vertieften Einblick in die molekulare Funktion von RSK als Regulator des molekularen circadianen Uhrwerks erhalten. Zweitens deuten erste vielversprechende Experimente auf eine Funktion von RSK in der Tageszeit-abhängigen morphologischen Plastizität der dorsalen Endigungen einer Subklasse von Uhrneuronen (den s-LNv) hin. In Verbindung mit unseren früheren Befunden im Motorneuronsystem der Fliege ergibt sich daraus die Frage, welche Bedeutung RSK für die synaptischen Eigenschaften und ERK gesteuerte Prozesse an diesen Terminalien hat. Geht mit dem Verlust der RSK Funktion eine Veränderung der neuronalen Verknüpfungen der s-LNv einher und führt dies zu Veränderungen in Zeit-abhängigen Verhaltensantworten? Ein dritter Schwerpunkt dieses Antrags baut auf unserem kürzlichen Befund zum Einfluss von RSK auf Furcht-ähnliches Verhalten auf und setzt sich zum Ziel, das zugrunde liegende RSK-abhängige neuronale Netzwerk und die circadiane Modulation dieses Verhaltens zu identifizieren und dabei den Einfluss der RSK-abhängigen Modulierung von G-Protein gekoppelten Signalwegen aufzuklären.Legt man die Ähnlichkeiten der neurochemischen und molekularen Signalwege zwischen Fliege und Mensch zu Grunde, so liefern die Ergebnisse im Rahmen dieses Drosophila Projekts eine Blaupause für ein generell verbessertes Verständnis der neuronalen Funktion von RSK auch beim Menschen und können uns daher helfen, die Ursachen der komplexen Pathophysiologie des Coffin-Lowry-Syndroms besser zu verstehen.
Tiere, die in nördlichen Breitengraden leben, sind ausgeprägten jahreszeitlichen Änderungen ihrer Umwelt ausgesetzt. Im Sommer erfahren sie lange Tage und kurze Nächte mit moderaten Temperaturen, die die Fortpflanzung erlauben, während die kurzen Tage und niedrigen Temperaturen des Winters spezielle Anpassungen zum Überleben erfordern wie zum Beispiel Frostresistenz und eine Unterbrechung der Fortpflanzung.
Im Gegensatz dazu erfahren Tiere, die nahe am Äquator leben, kaum jahreszeitliche Änderungen und Einschränkungen in der Fortpflanzung.
Die circadiane Uhr im Gehirn ist dafür bekannt, Tag-Nacht Rhythmen in der Aktivität zu kontrollieren und zusätzlich eine interne Zeitreferenz für die Tageslängenmessung zu liefern. Letztere ist wichtig für die rechtzeitige Vorbereitung auf den Winter.
Wir haben herausgefunden, dass sich die molekularen Oszillationen der Uhrproteine Period (PER) und Timeless (TIM) signifikant an kurzen Winter- und langen Sommertagen.
Interessanterweise reagieren diese Fliegen auf Kurztage mit einer Änderung der Zusammensetzung des kutikularen Kohlenwasserstoffprofils. Um die Evolution circadianer Uhren zu verstehen, planen wir das Uhrnetzwerk im Gehirn, das tägliche Aktivitätsmuster und das kutikulare Kohlenwasserstoffprofil von weiteren Drosophila Arten zu untersuchen.
Um die Rolle der circadianen Uhr bei der Tageslängenmessung zu verstehen, werden wir D. melanogaster Fliegen untersuchen. Insbesondere werden wir testen, ob es einen kausalen Zusammenhang zwischen Tageslänge, PER/TIM Oszillationen und der Zusammensetzung des kutikularen Kohlenwasserstoffprofils gibt, indem wir Uhrmutanten untersuchen, deren circadiane Uhr sich nicht mehr an die jahreszeitlichen Änderungen anpassen kann und die sich deswegen in einem permanenten Sommer- oder Winterzustand befinden. Wir versprechen uns von den Untersuchungen am gut charakterisierten Modellsystem Drosophila ein besseres generelles Verständnis der Rolle der circadianen Uhr in der jahreszeitlichen Anpassung von Tieren.
Die circadiane Uhr ermöglicht es Tieren, sich im Voraus auf den Tag-Nacht-Wechsel vorzubereiten. Manchen Arten nutzen ihre Uhr auch zum Zeitgedächtnis, zum Messen der Tageslänge um jahreszeitliche Änderungen vorherzusehen, sowie für die zeitkompensierte Himmelskompassorientierung. Das Uhrnetzwerk im Gehirn der Taufliege gehört zu den bestuntersuchten. Es besteht aus miteinander kommunizierenden lateralen und dorsalen Uhrneuronen, die einen circadianen molekularen Rhythmus erzeugen und diesen an nachgeschaltete Neuronen im dorsalen Protocerebrum weitergeben. Die Taufliege ist ein Modell in der Schlafforschung, es gelang, Verbindungen der circadianen Uhr zum Metabolismus aufzuschlüsseln, zu zeigen, dass Taufliegen ein Zeitgedächtnis besitzen und dass die circadiane Uhr bei der Induktion der Winterruhe eine Rolle spielt. Erste Untersuchungen deuten darauf hin, dass die Fliege sogar zur zeitkompensierten Himmelkompassorientierung befähigt ist. Bei all diesen Funktionen scheinen die dorsalen Uhrneurone eine wichtige Rolle zu spielen. Während die lateralen Uhrneurone als übergeordnete „circadiane Masteroszillatoren“ gelten, sind die dorsalen Neurone multimodale Integratoren, die den Rhythmus an Interneurone und neurosekretorische Zellen weitergeben. In der Literatur finden sich allerdings widersprüchliche Angaben zur genauen Funktion der dorsalen Uhrneurone. So machen manche Autoren eine Gruppe der dorsalen Uhrneurone (DN1p) für die Induktion des Schlafes verantwortlich, während andere Autoren eine Rolle der gleichen Neuronen bei der Erhöhung des Stoffwechsels und der neuronalen Erregung postulieren. Ein Grund für die widersprüchlichen Ansichten könnte im unterschiedlichen Projektionsmuster individueller dorsaler Uhrneurone liegen.
Für Tiere ist es lebenswichtig, Entwicklung und physiologische Aktivität der verschiedenen Körpersysteme zeitlich aufeinander abzustimmen, und in Einklang mit den gezeigten Verhaltensäusserungen zu bringen. Die zeitliche Abstimmung von Entwicklung, physiologischer Aktivität und Verhalten ist dabei abhängig von einer Zeitschaltuhr (repräsentiert durch zentrale und periphere Innere Uhren) sowie einem integrierenden Kommunikationssystem (repräsentiert durch das (neuro)endokrine System). Allerdings wissen wir bisher wenig über die komplexen neuronalen und endokrinen Signalwege und die zugrunde liegenden molekularen und zellulären Signalmechanismen, über die Innere Uhren und das (neuro)endokrine System miteinander wechselwirken. Wissen hierüber könnte jedoch einen Weg eröffnen, um damit zusammenhängende Entwicklungsstörungen und circadiane Dysfunktionen wie z.B. beeinträchtigte Fertilität, Schlafstörungen und psychiatrische Probleme besser zu verstehen und zu behandeln. Als Ziel des Projekts steht die Aufklärung der Wechselwirkungen zwischen Entwicklungs- und circadianen Uhren und dem neuroendokrinen System. Dabei möchten wir auch beginnen, zelluläre und molekulare Wirkmechanismen zu charakterisieren. Ein Hauptaugenmerk liegt auf der Wechselwirkung zwischen Peptid- und Steroidhormonsignalwegen und ihrer circadianen Kontrolle. Wir wollen herausfinden, wo genau circadiane und entwicklungsabhängige Zeitsignale im Gehirn integriert werden, um ein spezifisches Verhalten zeitlich zu steuern. Das spezifische Verhalten, das hier beispielhaft untersucht wird, ist das Schlupfverhalten der Taufliege Drosophila. Drosophila ist ein sehr gutes Modellsystem für das Projekt, da sie genetisch-experimentell hervorragend zugänglich ist, und ihr Nervensystem aus vergleichsweise wenigen und individuell identifizierbaren Nervenzellen besteht. Dies wird es auf lange Sicht ermöglichen, die neuronalen und hormonellen Verbindugen zwischen zentralen und peripheren Inneren Uhren und Zielgeweben von der molekularen bis zur systemischen Ebene vollständig aufzuklären. Der Schlupf ist ein sehr geeignetes Modellverhalten, da es sowohl durch die Entwicklung als auch durch Innere Uhren zeitlich festgelegt ist, und dabei durch Peptid- und Steroidhormone gesteuert wird. Die Wahl des richtigen Schlupfzeitpunkts ist entscheidend für die evolutionäre Fitness von Insekten und anderen Gliedertieren. Zu dieser Tiergruppe lassen sich ca. zwei Drittel aller Tierarten zuordnen. Daher ist es auch aus rein zoologischer Sicht sehr interessant, die Mechanismen für die zeitliche Festlegung des Schlupfs aufzuklären
Die Mitogen-aktivierte Protein Kinase ERK als Bestandteil des gleichnamigen Signalwegs reguliert eine Vielzahl intrazellulärer Prozesse. Obwohl hauptsächlich im Kontext von Proliferation, Differenzierung und Apoptose betrachtet, werden über ERK unter anderem auch neuronale und circadiane Prozesse reguliert. In Folge dessen führt die Fehlregulation des ERK Signalsignalwegs nicht nur zu Tumorgenese, sondern ist auch mit neuronalen Fehlfunktionen und neuropsychiatrischen Erkrankungen verbunden.RSK Proteine erfüllen bei der Weiterleitung von ERK Signalen vielfältige Funktionen, die jedoch insbesondere im Nervensystem nur sehr unvollständig verstanden sind. Dies drückt sich in dem leider unzureichenden Kenntnisstand zur Pathophysiologie aus, die durch Mutation des menschlichen rsk2 Gens verursacht wird und zu schwersten geistigen Beeinträchtigungen führt (Coffin-Lowry-Syndrom). Dieser Antrag zielt darauf ab, im Modellsystem Drosophila melanogaster neuronale Funktionen von RSK aufzuklären. Dabei nutzen wir das Netzwerk der Uhrneuronen als besonders geeignetes experimentelles Modell für einen integrativen Ansatz, der die Brücke zwischen der molekularen Analyse, den zellulären/physiologischen Prozessen und der Verhaltensebene schlägt. Auf der Grundlage unserer früheren Befunde wollen wir zunächst einen vertieften Einblick in die molekulare Funktion von RSK als Regulator des molekularen circadianen Uhrwerks erhalten. Zweitens deuten erste vielversprechende Experimente auf eine Funktion von RSK in der Tageszeit-abhängigen morphologischen Plastizität der dorsalen Endigungen einer Subklasse von Uhrneuronen (den s-LNv) hin. In Verbindung mit unseren früheren Befunden im Motorneuronsystem der Fliege ergibt sich daraus die Frage, welche Bedeutung RSK für die synaptischen Eigenschaften und ERK gesteuerte Prozesse an diesen Terminalien hat. Geht mit dem Verlust der RSK Funktion eine Veränderung der neuronalen Verknüpfungen der s-LNv einher und führt dies zu Veränderungen in Zeit-abhängigen Verhaltensantworten? Ein dritter Schwerpunkt dieses Antrags baut auf unserem kürzlichen Befund zum Einfluss von RSK auf Furcht-ähnliches Verhalten auf und setzt sich zum Ziel, das zugrunde liegende RSK-abhängige neuronale Netzwerk und die circadiane Modulation dieses Verhaltens zu identifizieren und dabei den Einfluss der RSK-abhängigen Modulierung von G-Protein gekoppelten Signalwegen aufzuklären.Legt man die Ähnlichkeiten der neurochemischen und molekularen Signalwege zwischen Fliege und Mensch zu Grunde, so liefern die Ergebnisse im Rahmen dieses Drosophila Projekts eine Blaupause für ein generell verbessertes Verständnis der neuronalen Funktion von RSK auch beim Menschen und können uns daher helfen, die Ursachen der komplexen Pathophysiologie des Coffin-Lowry-Syndroms besser zu verstehen.