RNA-Spleißen in Menschlichen Erkrankungen
Das RNA-Spleißen ist einer der wichtigsten Regulierungsmechanismen in eukaryontischen Zellen. Dereguliertes Spleißen ist die Ursache für verschiedene pathologische Zustände, wie Retinitis pigmentosa (RP). Proben von RP-Patienten zeigen eine Verarmung der ubiquitinspezifischen Protease 39 (USP39).
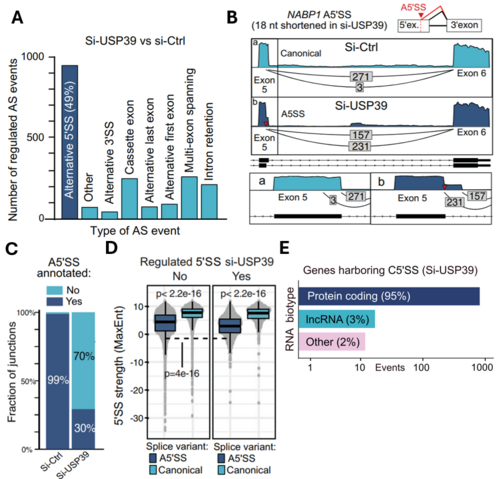
Um die zugrundeliegenden Mechanismen von Spleiß-assoziierten Krankheiten zu erforschen, haben wir Zellen mit einem Knockout von USP39 analysiert. Diese Proben zeigen eine starke Regulierung alternativer 5'-Spleißstellen, die eine Verlängerung oder Verkürzung des Exons vor oder hinter der kanonischen Spleißstelle beinhalten (A,B). Die meisten der neu verwendeten Spleißstellen sind im Referenzgenom nicht annotiert (C). Dieses so genannte kryptische Spleißen wird häufig durch eine fehlerhafte Erkennung suboptimaler Spleißstellen verursacht. Tatsächlich sind die kryptischen Spleißstellen, die bei USP39 KO verwendet werden, deutlich schwächer als ihre kanonischen Gegenstücke, was auf Probleme bei der Erkennung von Spleißstellen hinweist (D). Darüber hinaus haben wir festgestellt, dass die Mehrzahl der betroffenen Gene proteinkodierend ist (E).
Auf der Grundlage dieser Ergebnisse konnten unsere Mitarbeiter zeigen, dass USP39 die Aggregation fehlgefalteter Proteine durch die Nutzung kryptischer Spleißstellen verstärkt, was schließlich zum Zelltod führt.
Die Ergebnisse diese Projekts wurden in Pietro-Gracia et al. 2024 publiziert.
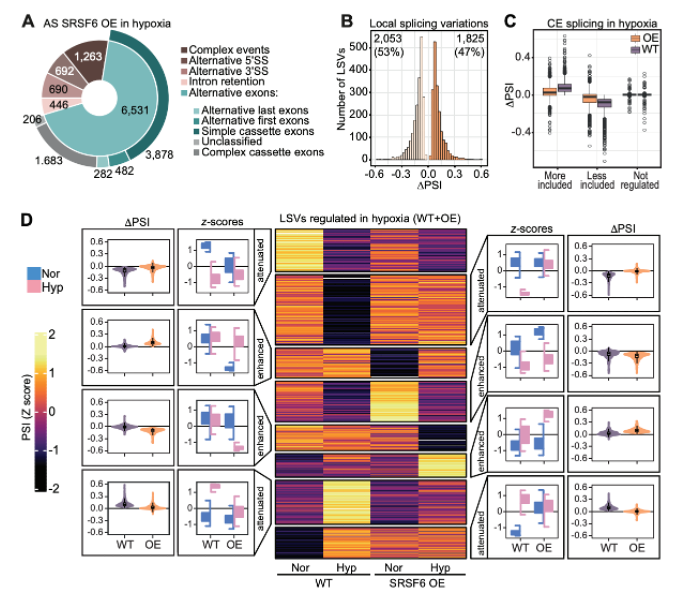
Hypoxie führt zu massiven Veränderungen im alternativen Spleißen (AS), um die Zellen an den Sauerstoffmangel anzupassen. In diesem Projekt wurde festgestellt, dass SRSF6 ein Schlüsselfaktor bei der AS-Reaktion auf Hypoxie ist. Eine starke Verringerung des SRSF6-Spiegels bei akuter Hypoxie führte zu Exon-Skipping, mit dem die Zelle das Genexpressionsprofil neu programmiert. Dieser Mechanismus ist in verschiedenen Krebsarten aktiv und erfüllt möglicherweise eine Tumorsuppressorfunktion.
In β-Zellen der Bauchspeicheldrüse fördert die Herunterregulierung von SRSF6 das Absterben von β-Zellen durch eine Dysregulation des Spleißens von zentralen Genen, welche für die Funktion und das Überleben von β-Zellen wichtig sind. In diesem Projekt haben wir die SRSF6 RNA-Bindestellen in pankreatischen β-Zellen charakterisiert und ein purinreiches SRSF6-Bindemotiv identifiziert. Wir zeigen, dass die SRSF6-Bindung an alternativen Exons das Spleißverhalten der RNAs bestimmt, da SRSF6 je nach Positionierung entweder Exon-Skipping oder Exon-Inklusion fördert. Diese Spleißveränderungen können durch den Einsatz von Antisense-Oligonukleotiden moduliert werden.
Der vollständige Artikel wurde veröffentlicht in
de Oliveira Freitas Machado et al., 2023 und Alvelos et al. 2020.