Signalnetzwerke in quergestreiften Muskelzellen
Quer gestreifte Muskelzellen sind ständig mechanischen Kräften ausgesetzt. Bei akuter mechanischer Belastung werden Proteinsignalnetzwerke und Proteostasewege sofort aktiviert und präzise reguliert, um die mechanischen Anforderungen der kontrahierenden Muskelzellen zu erfüllen und aufrechtzuerhalten.
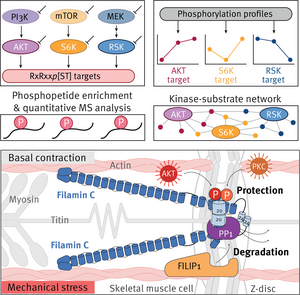
In diesem Forschungsschwerpunkt beschreiben wir systematisch phosphorylierungsabhängige Signalwege und identifizieren ihre spezifischen Ziele in mechanisch belasteten Myozyten. Phosphosignalnetzwerke umfassen reversible und ortsspezifische Phosphorylierungsreaktionen, die von Kinasen und Proteinphosphatasen gesteuert werden und die Zellfunktionen und das Zellschicksal bestimmen. Um solche großen Proteinphosphorylierungsnetzwerke zu beschreiben, verwenden wir globale und gezielte quantitative Phosphoproteomik-Ansätze in Kombination mit High-End-Massenspektrometrie-Technologie. Auf der Grundlage unserer Myotube-Phosphoproteomdaten haben wir die myofibrilläre Z-Scheibe als einen Proteinphosphorylierungs-Hotspot in quergestreiften Muskelzellen identifiziert. Insbesondere untersuchen wir die komplexe Regulation des myozytären Signaladaptors und mechanosensitiven Proteins Filamin C (FLNC). Dieses große Aktin-Vernetzungsprotein ist für die Bildung, die Integrität und die Aufrechterhaltung von Sarkomeren unerlässlich. Mutationen des FLNC-Gens führen beim Menschen zu schweren Myopathien und Kardiomyopathien, was die große Bedeutung unserer Forschung für die menschliche Gesundheit und Krankheit unterstreicht.
In unserer aktuellen Arbeit möchten wir ein mechanistisches Verständnis der Funktion und Regulierung von FLNC sowohl unter basalen als auch unter akuten mechanischen Stressbedingungen gewinnen. Bislang haben wir mehr als 30 durch mechanischen Stress regulierte FLNC-Phosphosites identifiziert. Darüber hinaus entdeckten wir, dass die zahlreichen Proteininteraktionen von FLNC sowie seine Dynamik und sein Umsatz durch verschiedene Proteinkinasen und Proteinphosphatasen durch ortsspezifische Phosphorylierungs-/Dephosphorylierungsreaktionen streng reguliert werden. So haben wir beispielsweise herausgefunden, dass die Interaktion zwischen FLNC und FILIP1 phosphoreguliert ist: Während FLNC durch Phosphorylierungen durch AKT und PKCa von der FILIP1-Bindung abgeschirmt wird, wird es unter akutem mechanischem Stress schnell durch PP1 dephosphoryliert, um den FILIP1-vermittelten FLNC-Abbau zu fördern. Wir schlagen vor, dass eine präzise Phosphoregulation von FLNC der Schlüssel zur Stabilisierung und Aufrechterhaltung von Sarkomeren in Skelettmuskelzellen während akuter mechanischer Belastung ist, was wir derzeit im Detail untersuchen.
Förderung
Diese Forschungslinie der AG Warscheid wurde im Rahmen der folgenden Projekte gefördert
-
FOR 2743 “Mechanical Stress Protection”, project 09 “Regulation of kinase-substrate networks in skeletal muscle cells under mechanical stress” https://www.biologie.uni-bonn.de/for2743/de
-
FOR 1352 ‘Structure, Function and Regulation of the Myofibrillar Z-disc Interactome’ project 04: ‘Study of Z-disc protein interaction and signaling networks’ (completed)
Ausgewählte Publikationen
-
 Filamin C dimerisation is regulated by HSPB7. . In Nature Communications, 16(1), p. 4090. 2025.
Filamin C dimerisation is regulated by HSPB7. . In Nature Communications, 16(1), p. 4090. 2025.- [ DOI ]
-
 Protein phosphatase-1 regulates the binding of filamin C to FILIP1 in cultured skeletal muscle cells under mechanical stress. . In Scientific Reports, 14(1), p. 27348. 2024.
Protein phosphatase-1 regulates the binding of filamin C to FILIP1 in cultured skeletal muscle cells under mechanical stress. . In Scientific Reports, 14(1), p. 27348. 2024.- [ DOI ]
-
 Identification of phosphatases that dephosphorylate the co-chaperone BAG3. . In Life Science Alliance, 8(2), p. e202402734. Life Science Alliance, LLC, 2024.
Identification of phosphatases that dephosphorylate the co-chaperone BAG3. . In Life Science Alliance, 8(2), p. e202402734. Life Science Alliance, LLC, 2024.- [ DOI ]
-
 Cardiac stress leads to regulation of Filamin C dimerisation via an ancient phosphorylation-modulated interaction with HSPB7. . In bioRxiv. Cold Spring Harbor Laboratory, 2024.
Cardiac stress leads to regulation of Filamin C dimerisation via an ancient phosphorylation-modulated interaction with HSPB7. . In bioRxiv. Cold Spring Harbor Laboratory, 2024.- [ DOI ]
-
 Phosphoproteomics Profiling Defines a Target Landscape of the Basophilic Protein Kinases AKT, S6K, and RSK in Skeletal Myotubes. . In Journal of proteome research, 22(3), pp. 768–789. United States, 2023.
Phosphoproteomics Profiling Defines a Target Landscape of the Basophilic Protein Kinases AKT, S6K, and RSK in Skeletal Myotubes. . In Journal of proteome research, 22(3), pp. 768–789. United States, 2023.- [ DOI ]
-
 Maintaining Proteostasis under Mechanical Stress. . In EMBO reports, 22(8), p. e52507. England, 2021.
Maintaining Proteostasis under Mechanical Stress. . In EMBO reports, 22(8), p. e52507. England, 2021.- [ DOI ]
-
 Order from Disorder in the Sarcomere: FATZ Forms a Fuzzy but Tight Complex and Phase-Separated Condensates with \($\alpha$\)-Actinin. . In Science advances, 7(22). United States, 2021.
Order from Disorder in the Sarcomere: FATZ Forms a Fuzzy but Tight Complex and Phase-Separated Condensates with \($\alpha$\)-Actinin. . In Science advances, 7(22). United States, 2021.- [ DOI ]
-
 Phosphoproteomics Identifies Dual-Site Phosphorylation in an Extended Basophilic Motif Regulating FILIP1-mediated Degradation of Filamin-C. . In Communications biology, 3(1), p. 253. England, 2020.
Phosphoproteomics Identifies Dual-Site Phosphorylation in an Extended Basophilic Motif Regulating FILIP1-mediated Degradation of Filamin-C. . In Communications biology, 3(1), p. 253. England, 2020.- [ DOI ]
-
 Myofibrillar Z-discs Are a Protein Phosphorylation Hot Spot with Protein Kinase C (PKC α) Modulating Protein Dynamics. . In Molecular & cellular proteomics : MCP, 16(3), pp. 346–367. United States, 2017.
Myofibrillar Z-discs Are a Protein Phosphorylation Hot Spot with Protein Kinase C (PKC α) Modulating Protein Dynamics. . In Molecular & cellular proteomics : MCP, 16(3), pp. 346–367. United States, 2017.- [ DOI ]