Artikel veröffentlicht: Regulierung von Filamin C durch Protein Phosphatase-1
29.11.2024Eine neue Studie, die von Johannes Zimmermann und seiner ehemaligen Kollegin Anja Schwäble aus dem Labor von Bettina Warscheid zusammen mit Thomas Kokot aus dem Labor von Maja Köhn durchgeführt wurde, untersucht die Rolle der Proteinphosphatase-1 (PP1) in Skelettmuskelzellen während mechanischer Belastung.
FLNc reguliert die Entwicklung und Erhaltung der Z-Scheibe in Skelettmuskelzellen
Für lebende Organismen ist es von grundlegender Bedeutung, verschiedene Formen von zellulärem Stress auszuhalten und zu überwinden und dabei ein funktionelles Proteom und eine Homöostase aufrechtzuerhalten. Unter diesen Stressoren wurde mechanische Kraft vor kurzem als eine wichtige Quelle für akuten oder chronischen zellulären Stress in multizellulären Organismen erkannt. Bei körperlicher Aktivität üben mechanische Belastungen erhebliche Kräfte auf quergestreifte Muskelzellen aus, insbesondere auf die mechanosensitiven Komponenten der myofibrillären Z-Scheibe, die die Grenze zwischen benachbarten Sarkomeren bildet. Aberrante Formen der Z-Scheibe und der mit der Z-Scheibe assoziierten Proteine werden mit verschiedenen Muskelerkrankungen in Verbindung gebracht, darunter Myopathien und Kardiomyopathien, die zu fortschreitender Muskelschwäche und Herzversagen führen.
Eine Schlüsselkomponente der myofibrillären Z-Scheibe ist das große aktinbindende Protein Filamin C (FLNc). FLNc wird vorwiegend in quergestreiften Muskelzellen exprimiert, während die beiden anderen Mitglieder der Filaminfamilie, FLNa und FLNb, ubiquitär in allen Geweben vorkommen. Filamine fungieren als strukturelle Gerüste und Signalplattformen, was durch ihre Struktur unterstützt wird, die eine aminoterminale aktinbindende Domäne umfasst, gefolgt von 24 immunglobulinähnlichen (Ig-ähnlichen) Domänen (d1-d24). Diese stäbchenförmige Struktur wird durch Scharnierbereiche ergänzt, die für Flexibilität sorgen, während die Carboxy-terminale d24-Domäne die Filamin-Homodimerisierung für eine effiziente Aktinvernetzung erleichtert. Aufgrund seiner strukturellen und dynamischen Eigenschaften ist FLNc von entscheidender Bedeutung für die Muskelentwicklung, den Aufbau der Z-Scheibe und die Aufrechterhaltung und Reparatur von Myofibrillen, die ständig mechanischen Belastungen ausgesetzt sind. Darüber hinaus führt ein Mangel an FLNc bei Mäusen zu embryonaler Letalität, und Mutationen im FLNC-Gen werden beim Menschen mit Skelettmyopathien und Kardiomyopathien in Verbindung gebracht.
Neue Erkenntnisse von Kokot et al.
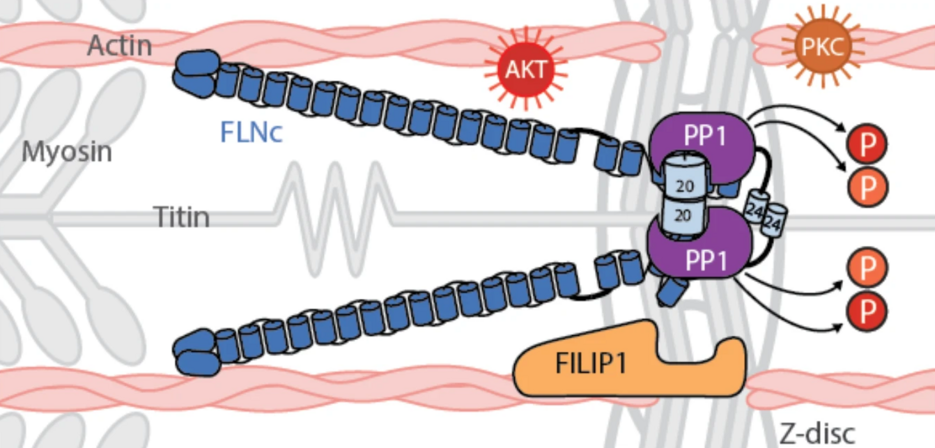
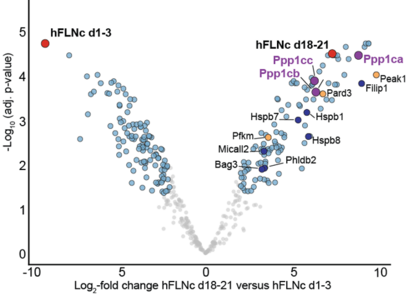
Bei mechanischer Belastung nimmt die Phosphorylierung von mFLNc-S2234 trotz erhöhter AKT-Aktivität ab, was auf eine dominante Rolle der Phosphatase-Aktivität bei der Regulierung dieser Stelle schließen lässt. Um dies weiter zu erforschen, wurden Affinitätsreinigungs-Massenspektrometrie (AP-MS, siehe Abbildung unten) und In-vitro-Tests durchgeführt, wobei die Proteinphosphatase 1 (PP1) als ein wichtiger Regulator identifiziert wurde. Die ergebnisseoffene AP-MS Analyse nahm hier eine zentrale Funktion bei der initialen Bestimmung von möglichen Interaktoren von FLNc ein, da sie sowohl die notwendige Sensitivität aufweist auch niedrig abundante Inteaktoren zu finden, als auch die Möglichkeit eröffnet, alle Proteine des humanen Proteoms bei dieser Analyse zu betrachten. Es zeigte sich, dass PP1 FLNc-pS2234 effizient dephosphoryliert und dadurch die FILIP1-Bindung erleichtert. Diese Ergebnisse unterstreichen, dass PP1 ein wichtiger Vermittler bei der reversiblen Regulierung von FLNc während mechanischer Belastung ist.
Darüber hinaus wurde festgestellt, dass die Bindung von FILIP1 an FLNc phosphorylierungsabhängig ist und direkt mit dem Abbau von FLNc zusammenhängt. Darauf aufbauend zeigt die Studie, dass die PP1c-vermittelte Dephosphorylierung von FLNc an S2233/S2234 dessen Interaktion mit FILIP1 in Skelettmuskelzellen signifikant erhöht. Insbesondere bestätigten Pulldown-Assays eine Zunahme der Bindung von rekombinantem und endogenem FLNc an FILIP1 nach einer PP1c-Behandlung, wodurch ein reversibler Regulationsmechanismus hervorgehoben wird, der durch die FLNc-Deposphorylierung gesteuert wird.
Zusammengenommen zeigt diese neue Studie, dass PP1 mFLNc-pS2234 in C2-Myotubes effizient dephosphoryliert. Durch diese Aktion bietet PP1 einen Mechanismus zur Regulierung der Bindung von FILIP1 an FLNc unter mechanischen Stressbedingungen und trägt damit zur dynamischen Anpassung von Muskelzellen an mechanische Belastungen bei.