Zellen machen keinen Blödsinn
16.01.2012Was muss passieren, damit Stammzellen sich zu reifen Zellen differenzieren? Diese Frage beschäftigt Forscher weltweit. Wissenschaftler vom Biozentrum der Uni Würzburg haben jetzt wichtige Details des komplexen Geschehens aufgeklärt. Sie sind dabei auf eine neuartige Form der Genregulation gestoßen.
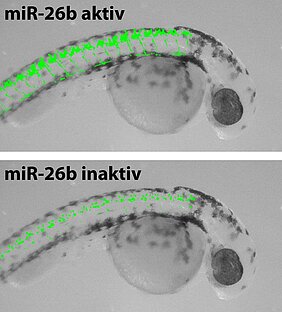
Neuronale Stammzellen tragen in ihrem Erbgut Informationen, die die Zellen benötigen, wenn sie sich zu reifen Nervenzellen entwickeln. Damit diese Gene aber nicht zum falschen Zeitpunkt aktiviert werden, sorgen andere Moleküle dafür, dass sie stillgelegt bleiben. Im Fall der neuronalen Stammzellen ist dies ein Proteinverband, der als REST-Komplex bezeichnet wird.
Das Stilllegen kann auf unterschiedlichen Wegen geschehen: Zum einen kann die Zelle daran gehindert werden, die auf dem DNA-Strang vorliegende Information überhaupt abzulesen. Bei der zweiten Variante wird die Information zwar abgelesen und verlässt dann als so genannte mRNA den Zellkern. Bevor die Zelle jedoch damit ein Protein bauen kann, das den Differenzierungsvorgang reguliert, greift ein weiterer Akteur ins Geschehen ein und verhindert die Proteinsynthese – die so genannte microRNA.
Forschung am Lehrstuhl für Biochemie
Ob mRNAs, microRNAs oder andere Formen, die vielseitigen RNA-Moleküle stehen im Mittelpunkt der Forschung am Lehrstuhl für Biochemie der Universität Würzburg. Am Beispiel von Zebrafischen und Mauszellen untersuchen hier Professor Utz Fischer und seine Mitarbeiter die komplexen Vorgänge in den Zellen. Über das jüngste Ergebnis ihrer Arbeiten berichtet die Fachzeitschrift Genes & Development in ihrer aktuellen Ausgabe. Die Entdeckung war den Herausgebern sogar einen eigenen Übersichtsbericht wert.
Fischer und seine Mitarbeiter Holger Dill, Bastian Linder und Alexander Fehr haben untersucht, welche Vorgänge ablaufen, wenn sich die Stammzelle zur Nervenzelle umwandelt. Dafür muss zunächst der REST-Komplex in seiner Aktivität gehemmt werden. Nur dann kann die genetische Information, die für die Differenzierung benötigt wird, ausgelesen werden und den Vorgang starten. Die Wissenschaftler sind dabei auf einen Regelkreis gestoßen, an dem überraschend wenige Akteure beteiligt sind.
Ein Wechselspiel aus Aktivierung und Hemmung
In diesem Fall stößt nämlich das Gen im Erbgut der neuronalen Stammzelle einerseits die Umwandlung in eine Nervenzelle an, andererseits blockiert es diesen Prozess sofort wieder. Oder, wie Utz Fischer erklärt: „Das Gen, das für die Stilllegung der Differenzierung in neuronalen Stammzellen verantwortlich ist, kodiert sowohl die dafür notwendige mRNA als auch gleichzeitig eine microRNA der miR-26 Familie.“ Und diese microRNA blockiert just die parallel mit ihr gebildete mRNA.
„Das ergibt auf den ersten Blick keinen Sinn. Aber wir wissen ja, dass Zellen normalerweise keinen Blödsinn machen“, sagt Utz Fischer. Die Wissenschaftler haben sich deshalb auf die Suche nach weiteren Faktoren begeben, die diese Blockade regulieren können. Fündig wurden sie bei einem Mechanismus, der die Entstehung der aktiven miR-26 microRNA solange unterdrückt, bis diese von der Zelle benötigt werden.
Wieso muss eine Stammzelle eigentlich daran gehindert werden, sich in eine Nervenzelle umzuwandeln? Schließlich ist das doch ihr eigentliches Ziel. „Weil man dann nur wenige Nervenzellen hätte und nicht die benötigten mehreren zig Milliarden“, sagt Linder. Stammzellen müssen sich also teilen und vermehren, bevor sie sich differenzieren. Das können sie allerdings nur, solange der Umwandlungsprozess blockiert ist.
Vielversprechender Ansatz für die Krebstherapie
Die Tatsache, dass die miR-26 microRNA Zellen zur Differenzierung anregt und somit den Teilungsprozess stoppt, ist auch aus medizinischer Sicht interessant – beispielsweise für eine potenzielle Krebstherapie. Schließlich ist die ungebremste Zellteilung das Hauptmerkmal von Krebs. Tatsächlich hat eine andere Forschergruppe von der Johns Hopkins Universität in Baltimore vor Kurzem auf diesem Gebiet einen vielversprechenden Erfolg verbucht: Sie konnte bei Mäusen mit einer bestimmten Form von Leberkrebs durch die Gabe von miR-26 microRNA das Tumorwachstum stoppen.
Das ist allerdings nicht die Richtung, in die Fischer und sein Team forschen. Sie betrachten ihre Arbeit eher als Grundlagenforschung: „Uns geht es darum, das Netzwerk der Regulation in einer Zelle und die zu Grunde liegenden Mechanismen zu verstehen“, sagt Linder. Und das sei mit der jüngsten Publikation perfekt gelungen: „Es wurde schon seit Längerem vorhergesagt, dass es Regelkreise geben muss, bei denen sich Gene quasi selbst hemmen. Wir konnten sie jetzt im lebenden Organismus nachweisen.“
Beendet ist die Suche damit noch lange nicht. „Es muss andere Faktoren geben, die die Bildung der aktiven microRNA regulieren“, sagt Linder. Die zu kennen, wäre „ein wichtiger Fortschritt“.
“Intronic miR-26b controls neuronal differentiation by repressing its host transcript, ctdsp2”, Holger Dill, Bastian Linder, Alexander Fehr and Utz Fischer. Genes & Development; doi:10.1101/gad.177774.111
„The enemy within: intronic miR-26b represses its host gene, ctdsp2, to regulate neurogenesis” Jinju Han, Ahmet M. Denli and Fred H. Cage. Genes & Development; doi:10.1101/gad.184416.111
Kontakt
Prof. Dr. Utz Fischer, T: (0931) 31-84029, E-Mail: utz.fischer@biozentrum.uni-wuerzburg.de